Hacia una quimioterapia más segura: la revolución de los metalofármacos y biocompuestos naturales
Arthrospira platensis, conocida comúnmente como espirulina, es una cianobacteria de alta relevancia en muchos sectores, entre ellos el alimentario, cosmético, médico, farmacéutico, etc., motivo por el cual representa una de las microalgas más cultivadas globalmente (Wu et al., 2021). Dada la riqueza de su composición nutricional, en la que se distinguen las proteínas (>60% de su peso seco), carbohidratos (10.3% p/p), lípidos (7.2% p/p), así como fibra cruda (8.5%) y minerales (6.9%) (Gentscheva et al., 2023), se utiliza para mejorar el perfil nutricional de los alimentos.
No obstante, al ser una fuente de sustancias bioactivas (moléculas capaces de ejercer efectos benéficos a la salud), tales como clorofilas, carotenoides, licopenos y ficobilinas, se ha comenzado a utilizar como ingrediente para mejorar no solo el perfil nutricional, sino también el funcional (capacidad de conferir algún beneficio a la salud más allá del valor nutrimental) de los alimentos, como en helados, chocolates, pan y pasta (García-Moncayo et al., 2023).
Efectos antidiabéticos (reducción de la glucosa en sangre), antiobesidad (regulación del metabolismo de lípidos y glucosa), hepatoprotectores (protección del hígado contra sustancias tóxicas), hipolipemiantes (reducción de niveles elevados de colesterol y triglicéridos en sangre), antiinflamatorios (reducción de mediadores de inflamación en tejidos), antigenotóxicos (protección del ADN contra mutaciones y daño genético), antinefrotoxicos (protección del riñón frente a toxinas), antitumorales (inhibición del crecimiento de células cancerosas), antimicrobianos (capacidad de inhibir o eliminar microorganismos patógenos), antivirales (actividad contra infecciones virales) y regulatorios en enfermedades neurodegenerativas (protección de células cerebrales y modulación del sistema nervioso) son algunos de los muchos beneficios que ofrece A. platensis, los cuales son atribuibles a su riqueza en sustancias bioactivas (Gentscheva et al., 2023; Fernandes et al., 2023). Sin embargo, la mayoría de los beneficios descritos clínicamente en la literatura sobre A. platensis se han adjudicado a su contenido en ficobiliproteínas.
Ficobiliproteínas
Las ficobiliproteínas son las principales proteínas fluorescentes que le permiten a A. platensis aprovechar la luz solar para la fotosíntesis (figura 1A). Se pueden subdividir en ficoeritrina (PE, de color rojo), ficocianina (PC, de color azul) y aloficocianina (APC, de color azul-verde), de acuerdo con el color de sus pigmentos (Fernandes et al., 2023).
Estas proteínas son comúnmente utilizadas como colorantes alimentarios gracias a sus vibrantes colores. Los pigmentos que le dan el color característico a estas ficobiliproteínas se denominan ficobilinas (del griego φύκος «phykos», que significa «bilis de alga”), los cuales son tetrapirroles de cadena abierta presentes en las ficobiliproteínas como pigmentos accesorios fotosintéticos en diversos tipos de cianobacterias y algas eucariotas (Mysliwa-Kurdziel y Solymosi, 2017) (figura 1B-1C).
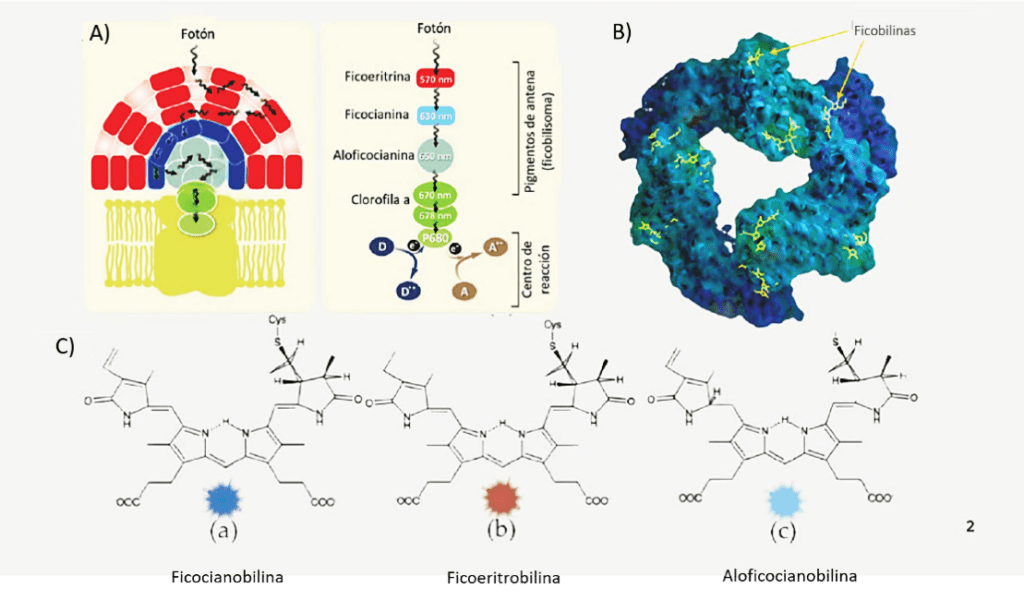
Figura 1. A) Ficobilisoma redirige luz para eficientar fotosíntesis (conjunto de ficobiliproteinas); B) ejemplo de hexámero de ficocianobilina con ficobilinas (amarillo); C) ficobilinas encontradas en A. platensis (ficocianina/azul, ficoeritrina/rojo, y aloficocianina/azul-verde) (modificado de Zuorro et al., 2021; SantaColor, s.f.).
Por lo tanto, las ficobiliproteínas forman un complejo proteína-pigmento que ensambla estructuras tipo antena (figura 1A) llamadas ficobilisomas, las cuales se encuentran ancladas en la membrana de los tilacoides (estructuras donde se localiza la clorofila en las cianobacterias y cloroplastos) y permiten captar luz en diversas longitudes de onda, redirigiendo los fotones a centros de reacción donde se encuentra la clorofila, haciendo más eficiente el proceso fotosintético (Stadnichuk y Tropin, 2017).
Es bien conocido que las principales ficobiliproteínas producidas por A. platensis son C-ficocianina (C-PC, la más abundante, representando 20% de su peso seco) y C-aloficocianina, presentes generalmente en una proporción 10:1. Sin embargo, también se ha reportado la presencia de pequeñas cantidades de ficoeritrina, aunque este aspecto sigue en debate (Stanic-Vucinic et al., 2018).
Ficocianina
La ficocianina y su cromóforo activo, la ficocianobilina (PCB), derivadas de A. platensis, han demostrado un amplio espectro de beneficios para la salud más allá de su uso como colorantes naturales. Estas moléculas poseen propiedades antioxidantes (previenen el daño celular causado por radicales libres), antiinflamatorias (modulan la respuesta inmune para reducir la inflamación) y anticancerígenas (inhiben la proliferación de células malignas), además de ofrecer neuroprotección (protección de neuronas), hepatoprotección (protección del hígado) y nefroprotección (protección de los riñones). También han mostrado efectos antimicrobianos (inhibición de bacterias y hongos patógenos), antidiabéticos (mejor regulación de la insulina) y antiobesidad (control del metabolismo lipídico), regulando el metabolismo y contribuyendo a la prevención de enfermedades crónicas. Su capacidad para estimular la cicatrización de heridas refuerza su potencial en medicina regenerativa (Stanic-Vucinic et al., 2018).
Además, la ficocianina actúa como un potente agente antiinflamatorio al reducir factores proinflamatorios como la interleucina-6 (IL-6, una citocina que participa en la inflamación y en la respuesta inmune) y el interferón gamma (IFN-γ, proteína clave en la defensa contra infecciones y regulación de la inflamación), mientras que aumenta la producción de citocinas antiinflamatorias como la interleucina-10 (IL-10, modulador del sistema inmune que suprime respuestas inflamatorias excesivas). Estos efectos son mediados por la inhibición de las vías de señalización inflamatorias NF-kB (factor de transcripción que controla la respuesta inmune e inflamatoria) y MAPK (familia de proteínas que regulan la proliferación celular y la inflamación). Estas características posicionan a la ficocianobilina en un nuevo nicho de investigación para el desarrollo de fármacos contra diversas enfermedades como complicaciones por covid-19, arteriosclerosis (acumulación de placas en arterias), esclerosis múltiple (enfermedad autoinmune que afecta la mielina en el sistema nervioso), accidente cerebrovascular isquémico (obstrucción del flujo sanguíneo en el cerebro) (Li, 2022), así como cáncer y enfermedades neurodegenerativas (Jiang et al., 2017; Pentón-Rol et al., 2021).
Metalofármacos
El cisplatino, un metalofármaco (fármaco basado en un metal) ampliamente utilizado en quimioterapia, actúa interfiriendo en la replicación del ADN de las células cancerosas, lo que lleva a su destrucción. Aunque es altamente efectivo en el tratamiento de diversas malignidades, como cáncer de ovario, pulmón y testículo, su elevada toxicidad y alto costo limitan su uso. No solo afecta a las células tumorales, sino también a los tejidos sanos, generando efectos secundarios severos. Esto lo convierte en una opción complicada para pacientes con comorbilidades (presencia de múltiples enfermedades crónicas) y multimorbilidades (varias afecciones crónicas simultáneamente), quienes son particularmente vulnerables a los tratamientos agresivos.
Además, las tendencias de incidencia y mortalidad del cáncer indican que las personas adultas mayores son el grupo poblacional más afectado tanto en incidencia como en mortalidad (International Agency for Research on Cancer, 2022) y a su vez son quienes presentan mayor cantidad de multimorbilidades (Plaza-López et al., 2024), lo que hace sumamente delicado su manejo como pacientes oncológicos.
Las guías clínicas actuales priorizan el tratamiento de la enfermedad maligna como el problema principal, dejando de lado las condiciones crónicas subyacentes, a pesar de que estas pueden modificar la evolución del cáncer, alterando su progresión y respuesta a los tratamientos (Panigrahi y Ambs, 2021). Esto resalta la necesidad de desarrollar terapias novedosas más asequibles, seguras y eficaces, que puedan ser utilizadas con mayor libertad sin comprometer la salud de pacientes.
Casiopeínas
Las casiopeínas representan una innovadora familia de metalofármacos de cobre desarrollados en México por Lena Ruiz Azuara, académica de la Universidad Nacional Autónoma de México (UNAM), como una alternativa a las terapias convencionales contra el cáncer. En comparación con el cisplatino, las casiopeínas han demostrado mayor seguridad de acuerdo distintos modelos animales (Aguilar-Jiménez et al., 2023).
Otro punto clave de las casiopeínas es su capacidad para evadir los mecanismos de resistencia tumoral, afectando múltiples vías de señalización y alterando la homeostasis del cobre en las células cancerosas, lo que limita la adaptabilidad del tumor a los tratamientos (Figueroa-DePaz et al., 2022). A diferencia del cisplatino, que afecta tanto a células tumorales como a sanas, las Casiopeínas han demostrado mayor especificidad, menor toxicidad y mejores características farmacocinéticas (proceso que determina la absorción, distribución, metabolismo y excreción de un fármaco), lo que las convierte en una opción más prometedora en oncología (García-Ramos et al., 2017; Figueroa-DePaz et al., 2022).
Las casiopeínas de tercera generación incluyen como ligando (molécula unida al cobre) un compuesto bioactivo, como curcuminatos (derivados de la curcumina, con propiedades antioxidantes y antiinflamatorias) o indometacina (antiinflamatorio no esteroideo), lo que amplía aún más su potencial terapéutico al hacer sinergia con las propiedades antineoplásicas (anticancerígenas) de la casiopeína (Figueroa-DePaz et al., 2022).
En el Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional (Cinvestav), unidad Zacatenco, en colaboración con la Facultad de Química de la UNAM y el Centro de Investigación en Alimentación y Desarrollo (CIAD), el estudiante del programa de maestría en ciencias con especialidad en farmacología Aldo Iván García Moncayo está investigando una estrategia innovadora: la combinación de ficocianobilina con casiopeínas de tercera generación. Durante una estancia en el CIAD, el estudiante aisló la ficocianobilina empleando un método novedoso de termopresión. Para ello, el tratamiento térmico y de presión, así como la posterior eliminación de contaminantes, se realizaron en estrecha colaboración entre el Laboratorio de Microbiología y Biología Molecular y el Laboratorio de Biotecnología y Bioingeniería del CIAD. En una primera etapa, se aplicó calor y presión a una mezcla de alcohol etílico al 70% con C-ficocianina, optimizando la extracción del cromóforo. Posteriormente, se llevaron a cabo procesos de purificación mediante rotoevaporación, lavados y centrifugación, lo que permitió obtener un aislado de ficocianobilina.
Este aislado será caracterizado mediante resonancia magnética nuclear (RMN) en el Departamento de Química del Cinvestav Zacatenco para corroborar la correcta obtención del cromóforo. Posteriormente, se sintetizarán compuestos de cobre a los cuales se les presentará la ficocianobilina. Finalmente, se caracterizará este nuevo compuesto para analizar los tipos de interacciones entre el ligando bioactivo (PCB) y la casiopeina, así como la evaluación del efecto antiproliferativo en células cancerosas en la Facultad de Química de la UNAM en conjunto con el Departamento de Farmacología del CINVESTAV Zacatenco
Este nuevo compuesto busca mejorar la eficacia del tratamiento contra el cáncer, reduciendo los efectos adversos que suelen afectar a pacientes que reciben quimioterapia. Este proyecto es dirigido por Francisco Javier Camacho (Oncofarmacología, Cinvestav Zacatenco, Departamento de Farmacología), en codirección con Lena Ruiz Azuara (Facultad de Química, UNAM), Mónica Alvarado González (Laboratorio de Microbiología y Biología Molecular, CIAD) y Carlos Martín Cerda García-Rojas (Cinvestav Zacatenco, Departamento de Química).
La combinación de casiopeínas con ficocianobilina representa un enfoque innovador en la lucha contra el cáncer, integrando la capacidad antitumoral de los metalofármacos de cobre con las antioxidantes, antineoplásicas y moduladoras del metabolismo de un cromóforo natural. Además, se ha evidenciado en estudios recientes que la ficocianobilina tiene el potencial de utilizarse como agente en terapia fotodinámica, ya que, al irradiarse con luz de longitud de onda de 660nm su estructura química, le posibilita generar especies reactivas de oxígeno (ROS) (Xiao et al., 2023), permitiendo aumentar el estrés oxidativo in situ sobre la masa tumoral, a la vez que la casiopeina contribuye con más estrés oxidativo. Esta sinergia podría potenciar la generación de especies reactivas de oxígeno (ROS) en células tumorales, aumentando su vulnerabilidad y mejorando la eficacia terapéutica. Al mismo tiempo, la ficocianobilina actuaría como un agente protector de células sanas, mitigando los efectos colaterales de los tratamientos convencionales y reduciendo la toxicidad sistémica.
Una ventaja clave de esta estrategia es su aplicabilidad en pacientes vulnerables, como aquellas personas con comorbilidades, multimorbilidades y personas adultas mayores, quienes presentan más complicaciones con las terapias estándar debido a su impacto adverso en órganos vitales. Además, la ficocianobilina ha demostrado potencial en la regulación de procesos inflamatorios y metabólicos, lo que no solo ayudaría en el tratamiento del cáncer, sino que también podría prevenir o mitigar enfermedades crónicas como diabetes, hipertensión y enfermedades cardiovasculares, que a menudo se presentan como comorbilidades en pacientes de oncología.
Referencias
Aguilar-Jiménez, Z., Espinoza-Guillén, A., Resendiz-Acevedo, K., Fuentes-Noriega, I., Mejía, C., & Ruiz-Azuara, L. (2023). The Importance of Being Casiopeina as Polypharmacologycal Profile (Mixed Chelate–Copper (II) Complexes and Their In Vitro and In Vivo Activities). Inorganics, 11(10), 394. https://doi.org/10.3390/inorganics11100394
Alemón-Medina, R., Breña-Valle, M., Muñoz-Sánchez, J. L., Gracia-Mora, M. I. y Ruiz-Azuara, L. (2007). Induction of oxidative damage by copper-based antineoplastic drugs (Casiopeínas®). Cancer chemotherapy and pharmacology, 60, 219-228.
Bhat, V. B. y Madyastha, K. M. (2001). Scavenging of peroxynitrite by phycocyanin and phycocyanobilin from Spirulina platensis: protection against oxidative damage to DNA. Biochemical and Biophysical Research Communications, 285(2): 262-266.
DiNatale, B. C., Murray, I. A. y Perdew, G. H. (2011). Ah receptor antagonism inhibits constitutive and cytokine-inducible IL6 production in human breast cancer cells. Biochemical Pharmacology, 82(5): 662-670.
Fernandes, R., Campos, J., Serra, M., Fidalgo, J., Almeida, H., Casas, A., … y Barros, A. I. (2023). Exploring the benefits of phycocyanin: from Spirulina cultivation to its widespread applications. Pharmaceuticals, 16(4): 592. https://doi.org/10.3390/ph16040592.
Figueroa-DePaz, Y., Pérez-Villanueva, J., Soria-Arteche, O., Martínez-Otero, D., Gómez-Vidales, V., Ortiz-Frade, L. y Ruiz-Azuara, L. (2022). Casiopeinas of third generations: synthesis, characterization, cytotoxic activity and structure-activity relationships of mixed chelate compounds with bioactive secondary ligands. Molecules, 27(11), 3504.
García-Moncayo, A. I., Ochoa-Reyes, E., Sáenz-Hidalgo, H. K., González-Pérez, P., Muñoz-Castellanos, L. N., Sepúlveda-Ahumada, D. R., … y Alvarado-González, M. (2024). Wheat Flour Pasta Combining Bacillus coagulans and Arthrospira platensis as a Novel Probiotic Food with Antioxidants. Foods, 13(21): 3381.
García-Ramos, J. C., Gutiérrez, A. G., Vázquez-Aguirre, A., Toledano-Magaña, Y., Alonso-Sáenz, A. L., Gómez-Vidales, V., … y Ruiz-Azuara, L. (2017). The mitochondrial apoptotic pathway is induced by Cu (II) antineoplastic compounds (Casiopeínas®) in SK-N-SH neuroblastoma cells after short exposure times. Biometals, 30, 43-58.
Gentscheva, G., Nikolova, K., Panayotova, V., Peycheva, K., Makedonski, L., Slavov, P., … y Yotkovska, I. (2023). Application of Arthrospira platensis for medicinal purposes and the food industry: a review of the literature. Life, 13(3): 845. https://doi.org/10.3390/life13030845.
International Agency for Research on Cancer (2022). Global Cancer Observatory: Cancer Today. Recuperado el 25 de noviembre de 2024 de https://gco.iarc.who.int/today/en/dataviz/maps-heatmap?mode=population&types=0.
Jiang, L., Wang, Y., Yin, Q., Liu, G., Liu, H., Huang, Y. y Li, B. (2017). Phycocyanin: a potential drug for cancer treatment. Journal of Cancer, 8(17): 3416.
Loboda, A., Damulewicz, M., Pyza, E., Jozkowicz, A. y Dulak, J. (2016). Role of Nrf2/HO-1 system in development, oxidative stress response and diseases: an evolutionarily conserved mechanism. Cellular and Molecular Life Sciences, 73(17): 3221-3247.
Li, Y. (2022). The bioactivities of phycocyanobilin from spirulina. Journal of Immunology Research, 2022(1): 4008991.
Mejia, C. y Ruiz-Azuara, L. (2008). Casiopeinas IIgly and IIIia induce apoptosis in medulloblastoma cells. Pathology & Oncology Research, 14, 467-472.
Mysliwa-Kurdziel, B. y Solymosi, K. (2017). Phycobilins and phycobiliproteins used in food industry and medicine. Mini Reviews in Medicinal Chemistry, 17(13): 1173-1193. https://pubmed.ncbi.nlm.nih.gov/27633748/.
Panigrahi, G. y Ambs, S. (2021). How comorbidities shape cancer biology and survival. Trends in Cancer, 7(6): 488-495. https://pubmed.ncbi.nlm.nih.gov/33446449/.
Pentón-Rol, G., Marín-Prida, J. y McCarty, M. F. (2021). C-Phycocyanin-derived phycocyanobilin as a potential nutraceutical approach for major neurodegenerative disorders and covid-19-induced damage to the nervous system. Current Neuropharmacology, 19(12): 2250-2275. https://doi.org/10.2174/1570159X19666210408123807.
Plaza-López, M. F., Valdez-Flores, M. A., de la Herrán-Arita, A. K., Osuna-Ramos, J. F., Angulo-Rojo, C. E., Llanos, A. M. G. y Norzagaray-Valenzuela, C. D. (2024). Prevalencia del síndrome metabólico y sus componentes en la población adulta de Culiacán, Sinaloa, México. Revista Médica de la Universidad Autónoma de Sinaloa (Revmeduas), 13(4): 367-378.
Rimbach, G., Huebbe, P. y Pool-Zobel, B. L. (2009). The role of phytochemicals in modulating Nrf2 and Nrf2-dependent gene expression in inflammation and cancer. Genes & Nutrition, 4(4): 199-210.
SantaColor. (s.f.). Phycocyanin in Spirulina. Recuperado el 27 de enero de 2025 de https://santacolor.com/phycocyanin-in-spirulina/.
Stadnichuk, I. N. y Tropin, I. V. (2017). Phycobiliproteins: structure, functions and biotechnological applications. Applied Biochemistry and Microbiology, 53(1), 1-10. https://link.springer.com/article/10.1134/S0003683817010185.
Stanic-Vucinic, D., Minic, S., Nikolic, M. R. y Velickovic, T. C. (2018). Spirulina phycobiliproteins as food components and complements. InTech. https://www.intechopen.com/chapters/59210.
Wu, H., Li, T., Lv, J., Chen, Z., Wu, J., Wang, N., … y Xiang, W. (2021). Growth and biochemical composition characteristics of Arthrospira platensis induced by simultaneous nitrogen deficiency and seawater-supplemented medium in an outdoor raceway pond in winter. Foods, 10(12): 2974.
Xiao, S., Lu, Z., Yang, J., Shi, X. y Zheng, Y. (2023). Phycocyanobilin from Arthrospira platensis: a potential photodynamic anticancer agent. Dyes and Pigments, 219, 111516.
Zuorro, A., Leal-Jerez, A. G., Morales-Rivas, L. K., Mogollón-Londoño, S. O., Sanchez-Galvis, E. M., García-Martínez, J. B. y Barajas-Solano, A. F. (2021). Enhancement of phycobiliprotein accumulation in thermotolerant Oscillatoria sp. through media optimization. ACS Omega, 6(16): 10527-10536. https://pubs.acs.org/doi/10.1021/acsomega.0c04665.
Autores(as): Aldo Iván García Moncayo, estudiante de la maestría en ciencias del Cinvestav Zacatenco, y Mónica Alvarado González, investigadora del CIAD subsede Delicias.































