GAPDH, una proteína multifacética
Hace muchos años se asumía que cada proteína fabricada en una célula cumplía solo con una función específica. Sin embargo, recientemente se ha demostrado que algunas proteínas pueden tener múltiples funciones que no están relacionadas o dependen de su función “canónica”. A las proteínas que hacen más de una acción o función se les conoce como moonlight proteins. Estas funciones alternativas son activadas por distintos factores, como la localización subcelular y la interacción con otras moléculas.1
Un ejemplo de proteína moonlight es la gliceraldehído-3-fosfato-deshidrogenasa (GAPDH), una enzima que está presente en todos los seres vivos. GAPDH participa en la glucólisis en el citoplasma y es esencial para producir energía química a partir de glucosa y esencial para la supervivencia de los organismos. Esta enzima tiene una cisteína muy conservada e indispensable para su actividad que, al oxidarse, pierde su actividad y el metabolismo de la glucosa es desviado hacia otras rutas metabólicas, como la de las pentosas-fosfato, donde se produce NADPH, una molécula necesaria para la actividad de los sistemas antioxidantes que contrarrestan el estrés oxidativo.2
La GAPDH se ha detectado en vertebrados en otros compartimientos celulares como mitocondria, núcleo, microtúbulos, vesículas, citoesqueleto, retículo endoplásmico, polisomas, aparato de Golgi y membrana plasmática. En estos compartimientos celulares, la GAPDH está involucrada en la reparación del DNA, exportación de ARNt, fusión y transporte de membranas, endocitosis, ensamblaje de membrana nuclear, muerte celular, inmunidad y senescencia, transportadora/receptora de hierro, etc. Esta multifuncionalidad de la GAPDH contribuye a la homeostasis celular y suele activarse cuando la célula se encuentra en un estado de “emergencia” como la deficiencia de oxígeno (hipoxia), cambios bruscos de temperatura y alta presión, entre otros.3,4
La hipoxia es un estresor común que afecta a organismos que habitan y se cultivan en ecosistemas marinos, como el camarón blanco (Penaeus vannamei). Estudios realizados en el Centro de Investigación en Alimentación y Desarrollo (CIAD) por el Laboratorio de Biología Molecular y Bioquímica de la Coordinación de Tecnología de Alimentos de Origen Animalhan encontrado que en granjas camaronícolas en la costa de Sonora, los niveles de oxígeno en los estanques fluctúan durante el día con una concentración máxima en horas de sol, pero que disminuye en horas de oscuridad.5 No obstante, el camarón blanco posee estrategias para enfrentar la limitación de oxígeno. Particularmente, los hallazgos indican que hay una aceleración de la glucólisis para producir energía (aunque sea poca) en ausencia de oxígeno. Por lo tanto, la producción de la GAPDH y de otras enzimas glucolíticas aumenta como una estrategia del camarón para sobrevivir a la hipoxia.6
Interesantemente, en el camarón blanco se ha podido localizar a la GAPDH en el núcleo de las células de branquias por medio de microscopía de inmunofluorescencia y anticuerpos específicos (véase figura 1), pero con su actividad canónica disminuida tanto en hipoxia como en condiciones normales de oxígeno, por lo que la GAPDH nuclear podría tener una función diferente a la citosólica.6 Así que encontrar y entender la función de la GAPDH nuclear en condiciones de estrés, podría dar luz sobre otras formas en que responden estos animales a condiciones adversas.
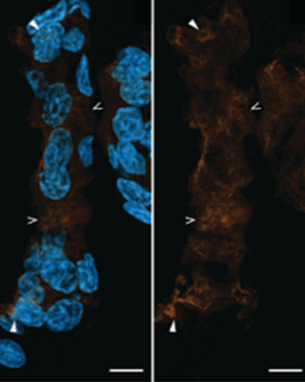
Figura 1: Inmunolocalización de la GAPDH en branquias de camarón blanco. La localización típica en el citosol se indica por las flechas abiertas, mientras que la localización nuclear se indica por las flechas cerradas. Tomado de Camacho-Jiménez et al., 2023.7
Referencias
1 Sirover, M. A. (2021). The role of posttranslational modification in moonlighting glyceraldehyde-3-phosphate dehydrogenase structure and function. Amino Acids, 53(4): 507-15.
2 Hildebrandt, T., Knuesting, J., Berndt, C., Morgan, B. y Scheibe, R. (2015). Cytosolic thiol switches regulating basic cellular functions: GAPDH as an information hub? Biol. Chem, 396(5): 523-537.
3 Tristan, C., Shahani, N., Sedlak, T. W., Sawa, A. (2011). The diverse functions of GAPDH: views from different subcellular compartments. Cell Signal, 23(2): 317-323.
4 Seidler, N. W. (2013). Chapter 3: Compartmentation of GAPDH in GAPDH: biological properties and diversity. Springer, pp. 61-101. DOI 10.1007/978-94-007-4716-6.
5 González Ruiz, N., Leyva Carrillo, L., Coronado Molina, D., Hernández López, J. y Yépiz Plascencia, G. M. (2023). Antioxidant stress response to fluctuations of dissolved oxygen and temperature in a semi-intensive aquaculture shrimp farm during high summer temperature. Invertebrate Survival Journal, 20: 65-78. https://www.isj.unimore.it/index.php/ISJ/article/view/803/505.
6 Camacho-Jiménez, L, Leyva-Carrillo, L, Peregrino-Uriarte, A. B., Duarte-Gutiérrez, J. L., Tresguerres, M. y Yepiz-Plascencia, G. (2019). Regulation of glyceraldehyde-3-phosphate dehydrogenase by hypoxia inducible factor 1 in the white shrimp Litopenaeus vannamei during hypoxia and reoxygenation. Comparative Biochemistry and Physiology, 235: 56-65.
7 Camacho-Jiménez, L., Peregrino-Uriarte, A. B., Leyva-Carrillo, L., Gómez-Jiménez, S. Thies, A. B., Tresguerres, M. y Yepiz-Plascencia, G. (2023). Effects of severe hypoxia and glyceraldehyde-3-phosphate dehydrogenase (GAPDH) knock- down on its gene expression, activity, subcellular localization, and apoptosis in gills of the shrimp Penaeus vannamei, Marine and Freshwater Behaviour and Physiology,56 DOI: 10.1080/10236244.2023.2216346.
Autoras(es): Lilia Leyva Carrillo, investigadora asociada; Jesús A. Rosas Anaya, estudiante del Doctorado en Ciencias del CIAD; Laura Camacho Jiménez, investigadora de Estancias Posdoctorales por México (Secihti), y Gloria Yépiz Plascencia, investigadora titular del Laboratorio de Biología Molecular y Bioquímica de la Coordinación de Tecnología de Alimentos de Origen Animal del CIAD.
CITACIÓN SUGERIDA:
Leyva Carrillo L. et al (2025, 20 junio). GAPDH, una proteína multifacética. Oficina de Prensa. Centro de Investigación en Alimentación y Desarrollo (CIAD). https://www.ciad.mx/gapdh-una-proteina-multifacetica/↗































